
有機半導体のメカニズムをより深く理解するために―先端化学科 中山泰生准教授に聞く―
電気を通す性質をもつ「有機半導体」は、柔らかく加工しやすいという特長から、有機ELや太陽電池などへの応用が進んでいます。中山泰生准教授は、有機物の「バンド幅」に着目し、電子がどのように移動するのかを測定することで、有機半導体が電気を通す仕組みの解明に取り組んでいます。
DNAやタンパク質とともに生命現象に重要な3つの鎖状分子の一つとされる「糖鎖」。中島将博准教授は、自然界にまだ数多くある知られざる糖鎖、そしてそれに関連する酵素について解明するべく研究を進めています。

DNAやタンパク質とともに生命現象に重要な3つの鎖状分子の一つとされるのが「糖鎖」です。中島将博准教授は、自然界にまだ数多くある知られざる糖鎖、そしてそれに関連する酵素について解明するべく、研究を進めています。未知なる領域に手探りで分け入るようなこの研究は、とても果てしないように見えますが、中島准教授は、「β-1,2-グルカン」というユニークな糖鎖を大量に合成する方法を確立し、それに関連する酵素を複数発見することを通じて、将来の医療や農薬開発に新しい道を開きうる大きな成果をあげています。糖鎖とは何か。そして、関連する酵素を探すことで何がわかるのか。この世界を深く掘り下げ続けてきた中島准教授に聞きました。
中島 将博(なかじま まさひろ) 2000年 東京大学農学部応用生命科学課程卒業、2006年 東京大学農学生命科学研究科応用生命工学専攻博士課程修了。博士(農学)。農業・食品産業技術総合研究機構 食品総合研究所、岩手生物工学研究所に研究員として勤務したのち、2012年に東京理科大学理工学部応用生物科学科助教。同講師を経て、2020年に同准教授。2023年、学部学科名の改称によって現職へ。
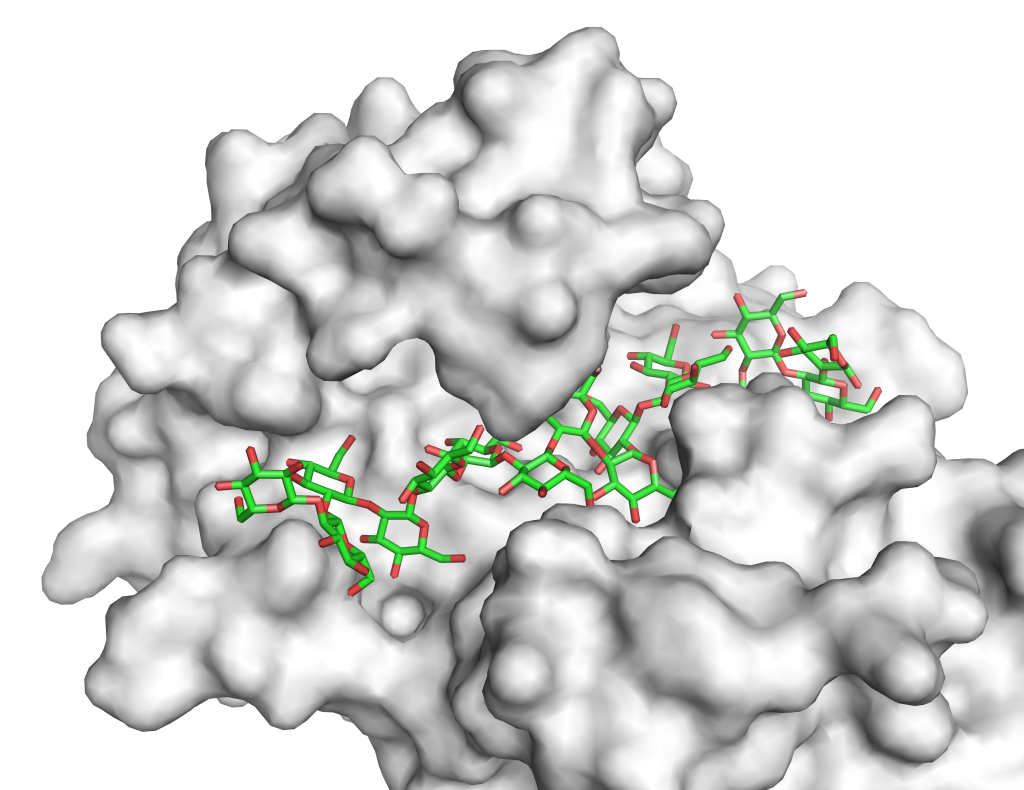
糖が鎖のように連なってできた化合物を「糖鎖」と言い、DNAやタンパク質とともに生命現象に重要な3つの鎖状分子の一つとされます。糖鎖は、生体内において様々な役割を持ち、分解してエネルギーとするだけではなく、細胞の識別や、細胞間のコミュニケーション(=結合など)にも関わっています。例えば、血液型は、赤血球の表面にある糖鎖によって決まっていますし、細菌やウイルスは、細胞表面の特定の糖鎖と結合することで感染します。
糖鎖は構造が複雑で種類もとても多く、6個の糖の結合の組み合わせだけで理論的にはその構造の種類が1兆以上になるとされています。その膨大な数からすると、私たちが糖鎖に関して知っていることは限られています。自然界には微量しか存在しない糖鎖も多いため、研究を深めるには、まずはそれを大量に合成する(=作る)ことが必要ですが、実際に合成でき、機能が理解されている糖鎖は多くはありません。そうした中、私は、未知の糖鎖を合成し、また、その糖鎖に作用する酵素を見つけ、それらの酵素がはたらくメカニズムを解き明かしながら、未知の糖鎖の役割や利用の可能性を探索するという研究を行っています。最近は、「β-1,2-グルカン」という、一般にはあまり知られていない糖鎖について、それに関連する酵素を探索し、その解析を行うことが中心的なテーマとなっています。

酵素とは、生体内で様々な化学反応を促進させる物質、すなわち、触媒です。糖鎖は、基本的には、酵素を触媒として糖と糖が結合していくことでできるものなので、糖鎖を合成するには、その糖鎖に作用する酵素が必要になります。ただし、未知の糖鎖を合成しようという場合、そもそもそれに必要な酵素が何なのかがわかりません。そのため、糖鎖を合成する研究では、それに関連する酵素を、何らかの方法で見つけることが重要になります。つまり、糖鎖を合成する研究では、酵素を探索することがセットになっていると考えてもらってよいと思います。
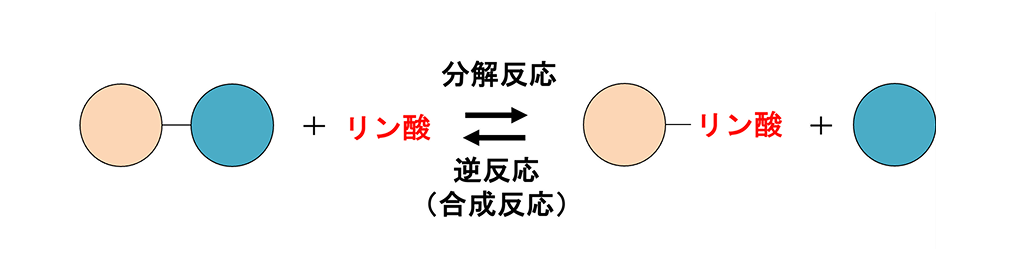
もともとは「加リン酸分解酵素(ホスホリラーゼ)」という酵素を探していたのがきっかけです。この酵素は、リン酸によって糖鎖の結合を切ったり、または逆に結合を作ったりできる性質があり、「分解酵素」と名前に入っているものの反応が可逆的で、簡単に糖鎖の合成に使えるなど興味深い酵素なのです。このタイプの酵素をいろいろと探していく中で私は、β-1,2-グルカンに作用する酵素を見つけ、β-1,2-グルカンを大量合成する方法を確立できました。そうしてβ-1,2-グルカンを合成できるようになったので、今度はそれを使って、β-1,2-グルカンを分解する酵素を探索するようになりました。私がβ-1,2-グルカンに着目するようになったのは2012年ごろですが、当時はそれを分解する酵素を指定する遺伝子がまだ一つも明らかになっていない状況でした。そこで、自分でやってみようと考えました。
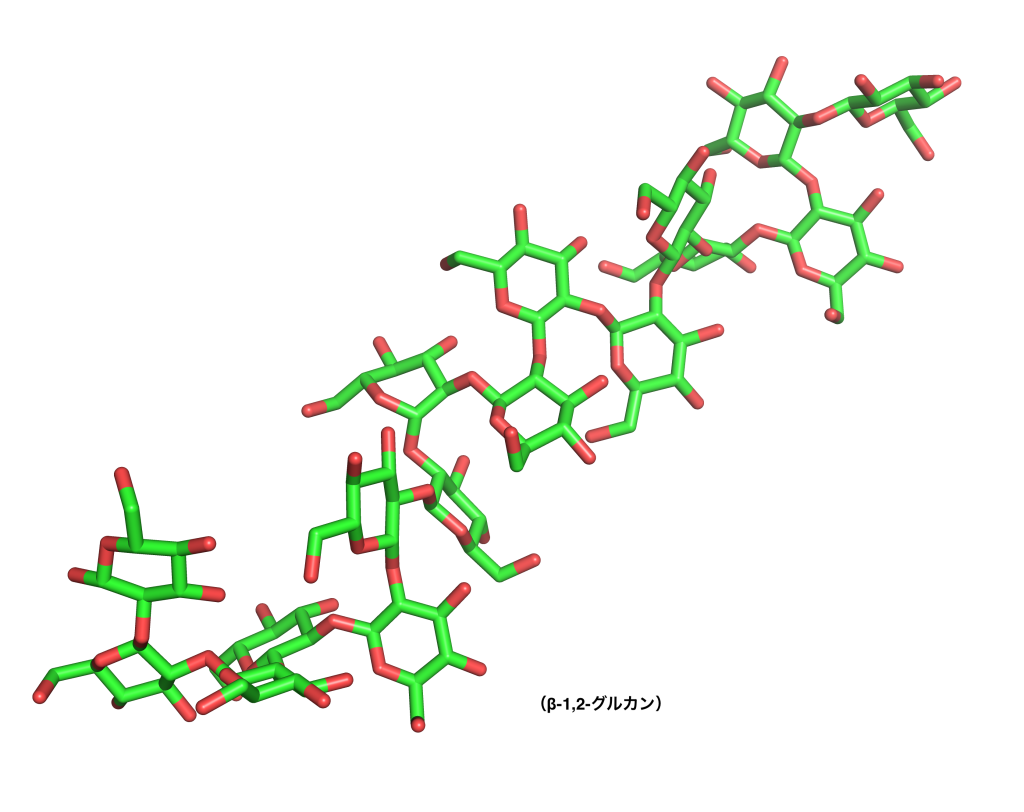
β-1,2-グルカンは、グルコース(=ブドウ糖)という、自然界に最も多くある糖が連なってできたものです。「β-1,2」の部分は、そのつながる場所とつながり方を示しています。私たちにとって最も身近な糖鎖とも言えるセルロースも、グルコースが連なったもので、同じような呼び方で書けば「β-1,4-グルカン」となります。つまり、β-1,2-グルカンとセルロースの違いと言えば、グルコースのつながる位置が少し違うというだけです。にもかかわらず、セルロースが地球上に非常に大量に存在する一方で、β-1,2-グルカンはとても希少で自然界に存在する量が全然違います。また、セルロースはほぼ水に溶けませんが、β-1,2-グルカンはとてもよく水に溶けるなど、全く性質も異なります。
そうした点からも、β-1,2-グルカンは興味深い存在なのですが、希少なため、利用という観点ではこれまでその性質がほとんど調べられていませんでした。しかし、私たちが大量合成法を確立したことで、β-1,2-グルカンに作用する酵素を探索することが可能になり、関連酵素を複数発見することができました。その中で私たちは、例えば、ある植物病原菌が植物に感染する時に必要な糖鎖を作る酵素を見つけました。つまり、その病原菌が植物に感染するメカニズムにはβ-1,2-グルカンが関係している可能性が推測できます。その他にも私たちは、様々なβ-1,2-グルカン関連酵素を発見していて、β-1,2-グルカンをベースとしたいろいろな糖鎖を作ることができるようになっています。今後、研究を進めていく中で、医療などの分野での応用が可能になっていくかもしれないと考えています。

私たちの場合、まずはβ-1,2-グルカンを培地に加えて微生物を培養しました。そして微生物がつくるβ-1,2-グルカンを分解する酵素を分離すると、その酵素を発現する遺伝子を決めることができました。これが探索の0から1にあたる部分です。その遺伝子の情報をもとにデータベースを調べると、どの生物が似た遺伝子を持っている、といったことがわかるので、そこからまた、類似の酵素を探っていって……、という具合に、鍵となる遺伝子を一つ見つけると、そこからどんどん新たな関連酵素の候補を見つけることができます。そしてそれらが、β-1,2-グルカンに作用するか、他の糖鎖にはどうか、といったことを調べていきます。

はい、そうですね。これは、X線を使って分子の立体構造を決める方法で、私たちの場合は、酵素とβ-1,2-グルカンが結合した際の立体構造をこの方法で調べています。どうやるかと言えば、まずは、酵素とβ-1,2-グルカンがくっついた状態の分子の結晶を作ります。その分子が溶けている溶液に、溶解度を下げるような物質を入れてやると、溶けきれなくなった分子が結晶となって現れるので、それを使います。そして、私たちの場合、その結晶をつくばの高エネルギー加速器研究機構(KEK)に持っていってX線をあて、そのデータを用いて解析を行います。すると、β-1,2-グルカンがその酵素にどのように結合しているかの形を観察でき、その形から酵素がなぜβ-1,2-グルカンに結合するのか、どのようなメカニズムでβ-1,2-グルカンを分解するのかが見えてきます。すると、β-1,2-グルカンやその関連酵素について、分子レベルで理解を深めていくことができます。

私たちのグループは、未知の糖鎖や酵素の解明を目指して研究を行っていますが、一般的にこの分野では、人間の腸内の細菌など、人と関係のある糖鎖や酵素を研究するケースが多いと思います。例えば、人間の腸内で大切なはたらきをしているビフィズス菌は、難消化性の糖鎖などを分解するユニークな酵素を持っているので、そういった酵素に着目して研究するという具合です。
そのような中で、私たちのように、人間との関係はわからず機能も役割も全く未知の新しい糖鎖や酵素を探索しようという研究者は少数派でしょう。ただ、人間は自然のごく一部ですので、人間との関わりの中だけを見ていると、生物というか自然界全体の持っている糖鎖と酵素の多彩な能力を見つけ出すことはなかなか難しいと思います。そういう意味で、自分のような研究者もこの分野には必要だと私は考えています。幸い、β-1,2-グルカンの研究で私たちは様々な関連酵素の発見を報告できていて、昨年はこれまでに発見されたことない形で結合をつなぎかえる酵素を発見しました。この発見は、糖鎖を合成する技術に大きな変化をもたらしうることに加え、全く新しいコンセプトの農薬開発にもつながる可能性があり、この成果は化学系のトップジャーナルにも掲載されました。全く未知の糖鎖を掘り下げて研究していくことの意味を、この成果は示しているのではないかと思っています。

そうですね、私自身、横断型コースの教員もやっていますので、異分野で融合して新しいものを生み出していこうという方針にはすごく共感しています。ただ、これまでお話ししてきた私自身の研究はかなり基礎研究寄りで、人間の社会や生活に深く関わっている“創域”からは少し離れているかもしれません。現状としては、まずは自分の持っているものを大事にして発展させるべきという気持ちが強いですね。そこをしっかりやっていった上で、結果として自然に他分野との融合が進んでいけばよいと思っています。
創域理工学部は、私みたいに融合の流れからは少し離れたところにいる研究者でも、「もっとこっち側に来い」と言われるわけではなく、居心地よく研究ができます。そういう懐の大きさが、結果として研究者の裾野を広げているようにも思います。様々な立場の研究者がメンバーにいて、必要な時には一緒に融合してやっていくための環境が整っているというのも、この学部の強みなのではないかと感じています。

誰も見たことがない新しいものを見たり見つけたりすることが、私にとっては、研究をする上での一番の面白さです。いまも新しい発見を確信した時にはとても興奮します。私はそのような「未知の探究」に強く惹かれるので、誰も探究できていないβ-1,2-グルカンと関連酵素の研究に取り組むようになりました。これからもきっと、未知なものを探っていこう、自分のオリジナルな領域を開拓していこうという気持ちは、ずっと持ち続けていくと思います。
そう言っていいと思います。この研究を始めて10年以上経ちますが、追随して来る人はほとんどなく、ほぼ私たちのグループだけが研究できている状況です。その一方で、先ほど少し言ったように、いろんな新しい技術にも応用しうる発見ができていて、研究を進めるほどに、さらにやりたいことが広がっています。自分にとってはとてもやりがいのある対象で、これからますます自分たちのオリジナティを深めていきたいと考えています。

最近の若い人は、「自分は何をやりたいか」というのをすごく若いうちから考えさせられているように感じます。就職活動でも、志望動機をちゃんと言えないといけなかったりしますよね。だけど、世の中には本当にいろんな分野や仕事があって、誰にとっても、知らないことの方が多いはずです。もちろん、高校生の時点で、これをやりたい、というのがはっきりある人は、それはそれでとてもよいことだと思いますが、大学に入ったら、予想もしていなかった面白い研究を知ることになったり、思わぬ出会いがあったりもするものです。なので、最初からあまりこれと決めすぎずに、新しいものに出会ったときに柔軟に反応できる状態でいることも大事かと思っています。
本学部は、“創域”を掲げていますが、先述の通り、必ずしも異分野融合を求められるわけではありません。自分の興味に沿って自由に研究することができ、とても裾野が広い学部だと思います。東京理科大学は、全体としてもそのような大学であり、だから、いろんなものに出会える可能性も大きいように感じます。そういう偶然の出会いに身を任せる良さも意識しながら、この大学を覗いてもらえたら嬉しいですね。
